- Wetenschappers maakten een kunstmatige vis van menselijke hartcellen die zelfstandig kan zwemmen.
- Het experiment is een eerste stap in de richting van het laten samenwerken van kunstmatige hartspieren in een laboratorium.
- Hoewel de vis een baanbrekende ontwikkeling binnen bio-engineering is, zijn we nog ver verwijderd van een kunstmatig menselijk hart.
- Lees ook: Wetenschappers hebben ontdekt hoe kikkers geamputeerde poten kunnen teruggroeien – dat biedt mogelijk ook perspectief voor mensen
Wetenschappers hebben een kunstmatige vis gemaakt van menselijke hartspiercellen die zichzelf kan voortbewegen. Dit zou de eerste stap kunnen zijn in de richting van het bouwen van een menselijk hart uit stamcellen in een laboratorium, laat een op donderdag gepubliceerde studie in Science zien.
Maar externe deskundigen zeggen dat er nog immense uitdagingen moeten worden overwonnen voordat die technologie in de kliniek toepasbaar wordt.
De groep wetenschappers die de vis heeft gefabriceerd, heeft zich al eerder gewaagd aan het maken van bizarre dieren uit cellen. Hun eerdere werk omvatte een robot-pijlstaartrog gemaakt van rattenhartcellen.
De projecten lijken misschien gewoon "grappig en cool", maar ze geven een uniek inzicht in de fysieke en mechanische eigenschappen van de hartspieren, vertelt Sung-Jin Park, auteur van de studie en assistent-professor biomedische techniek aan de Emory University en Georgia Tech.
Bio-ingenieurs zoals Park willen kunstmatig menselijk weefsel ontwerpen dat even goed, of zelfs beter, werkt dan natuurlijk hartweefsel, zegt hij. Dat betekent dat ze de harten van patiënten zouden kunnen repareren met diens eigen cellen.
"Ons uiteindelijke doel is om een kunsthart te bouwen ter vervanging van een misvormd hart bij een kind", zei Kit Parker, medeauteur van het artikel in een persbericht. Hij is bio-ingenieur aan de John A. Paulson School of Engineering and Applied Sciences van Harvard.
Wetenschappers bouwen een vis om het menselijk hart te bestuderen
Het hart en de hersenen functioneren bijna onafhankelijk van elkaar. Een opeenvolging van elektrische signalen zet de hartspieren aan tot een gespreide samentrekking, om het bloed door het hart te pompen, zoals in de video hieronder.
Dit team van wetenschappers is minder geïnteresseerd in het nabootsen van de structuur van een natuurlijk hart, en meer in het ontwikkelen van een betere versie van het menselijk hart, aldus Park.
In de studie onderzochten zij of spierceleiwitten kunnen worden gebruikt om een samentrekking op gang te brengen. Als een spier zich strekt, gaan de poriën aan de oppervlakte van de spiercellen open, waardoor specifieke voedingsstoffen kunnen binnendringen. Dat signaal is soms voldoende om de spiercellen uit zichzelf te laten samentrekken.
Als twee spieren op elkaar gestapeld zijn, en de ene verkort, verlengt dat de andere, die op zijn beurt kan terugschieten, waardoor de eerste spier langer wordt.
De onderzoekers wilden zien of ze dat effect konden creëren met hartspiercellen. De namaakvis werd gemaakt door menselijke hartstamcellen in twee spierlagen aan weerszijden van de staart te plaatsen. Die spieren werden vervolgens gemonteerd op een plastic structuur met vinachtige uitsteeksels, waardoor de vis in het water kon worden geplaatst.
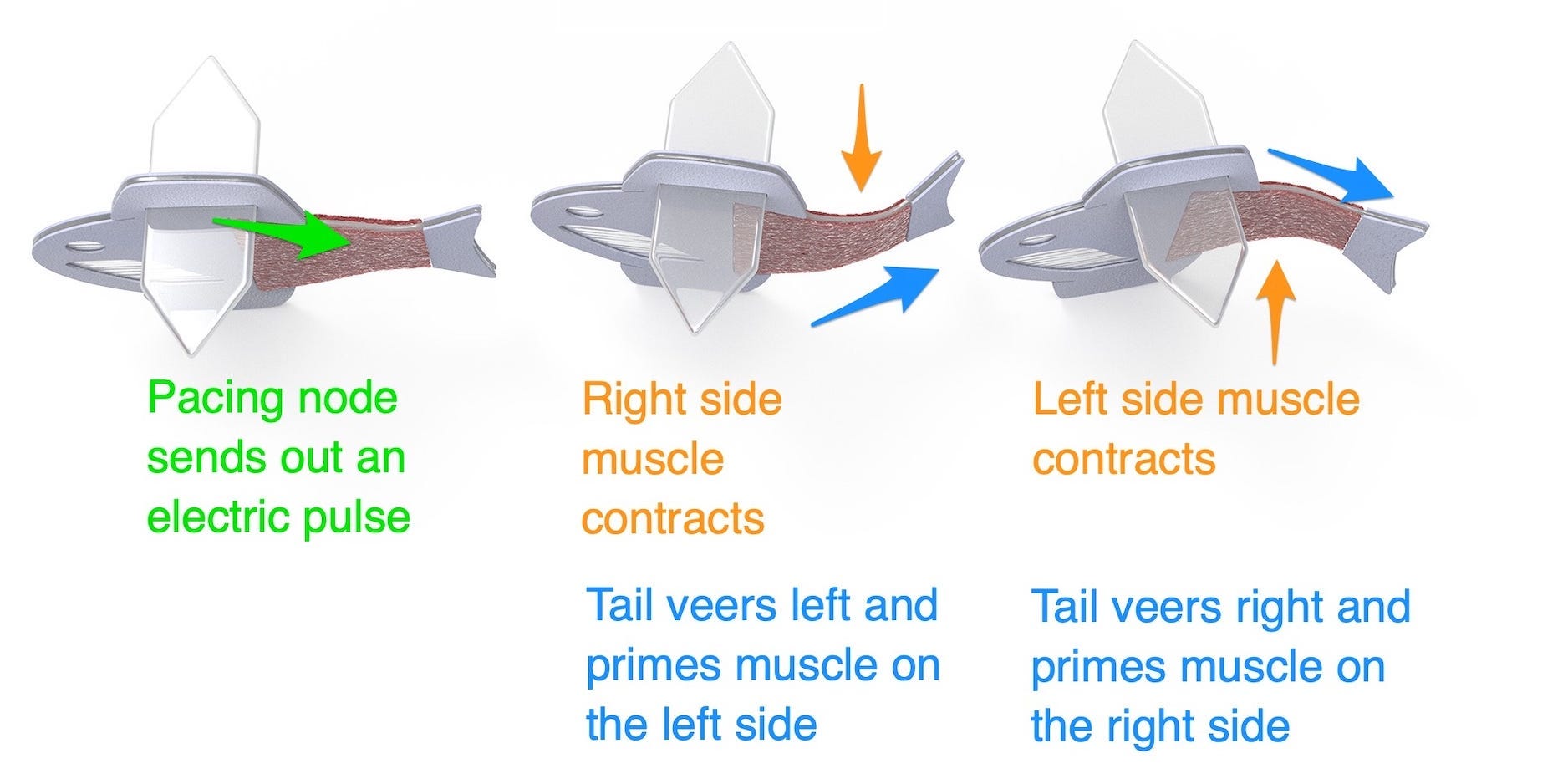
Door de spieren op die manier op elkaar te stapelen, kon de staart van de vis dagenlang onafgebroken heen en weer bewegen, zonder prikkels van buitenaf.
Toen het kwispelen van de staart na verloop van tijd zwakker werd, voegden de onderzoekers een autonoom pacingknooppunt toe aan de vis, of een kleine structuur die werkt als een pacemaker en regelmatig elektrische impulsen afgeeft aan het systeem.
Hiermee kon de vis meer dan 100 dagen blijven bewegen zonder hulp van buitenaf.
Het maken van weefsel dat uit zichzelf kan pulseren is een eerste stap in de richting van een van de einddoelen van het team: Het maken van een kunstmatige, zelfpulserende spier, die delen van het menselijk hart zou kunnen vervangen als die niet langer kunnen samentrekken na een hartaanval.
Een kloppend kunsthart is nog ver weg
Michael Schneider, een professor in regeneratieve cardiologie aan het Imperial College in Londen, die niet bij de studie betrokken was, vertelde Insider dat het onderzoek een technisch hoogstandje was.
Maar hij waarschuwde dat de technologie nog lang niet in de kliniek kan worden gebruikt.
In de race om de eerste definitieve behandeling voor hartfalen in het eindstadium te ontwikkelen, is een transplantatie van genetisch veranderende varkensharten -die dit jaar voor het eerst bij een mens werd toegepast- veelbelovender, denkt Schneider.
Park beaamt dat dit experimentele onderzoek nog in de kinderschoenen staat. Het kan nog minstens tien jaar duren voordat wetenschappers in staat zijn een kunstmatige spier te bouwen die een menselijk hart kan vervangen, voegde hij eraan toe.
Maar dat betekent niet dat het onderzoek van zijn team moet worden afgewezen.
"Ik denk dat andere methoden sneller zullen zijn dan wij," zei Park. Maar op de lange termijn zou het creëren van weefsel op basis van de eigen cellen van de patiënt, onverwachte voordelen kunnen bieden ten opzichte van varkensorganen of synthetische alternatieven, voegde hij eraan toe.
Lees meer over wetenschap:
- Elon Musk wil dit jaar zijn Neuralink-chip testen op mensen, maar veel apen die het hersenimplantaat kregen stierven na ‘extreem lijden’, zegt dierenrechtengroep
- Alcoholgebruik is nog maandenlang terug te zien in je haar – wetenschappers kijken nu of ze een alcoholprofiel kunnen maken voor leverpatiënten
- Deze 5 gewoontes kunnen ervoor zorgen dat je meer dan tien jaar langer leeft – blijkt uit een groot onderzoek van Harvard










